Bảng tuần hoàn hóa học
Bảng tuần hoàn các nguyên tố được biên soạn vào năm 1869 bởi nhà hóa học người Nga – Dmitri Mendeleev. Bảng tuần hoàn nguyên tố hóa học giúp mọi người dễ dàng sắp xếp, nhận biết cũng như nắm được quy luật của các nguyên tố hóa học.
Khi các nguyên tố được phát hiện mới, bảng tuần hoàn cũng trải qua nhiều lần điều chỉnh. Tuy nhiên, với hình thức hiển thị cơ bản vẫn được giữ nguyên so với thiết kế lúc đầu của Mendeleev.
Giá trị cốt lõi mà bảng tuần hoàn nguyên tố hóa học mang lại đó là khả năng phân tích tính chất hóa học của một nguyên tố cụ thể dựa vào vị trí của chúng trong bảng. Ngoài được áp dụng khi học Hóa, bảng tuần hoàn cũng được ứng dụng trong 2 môn Lý và Sinh.
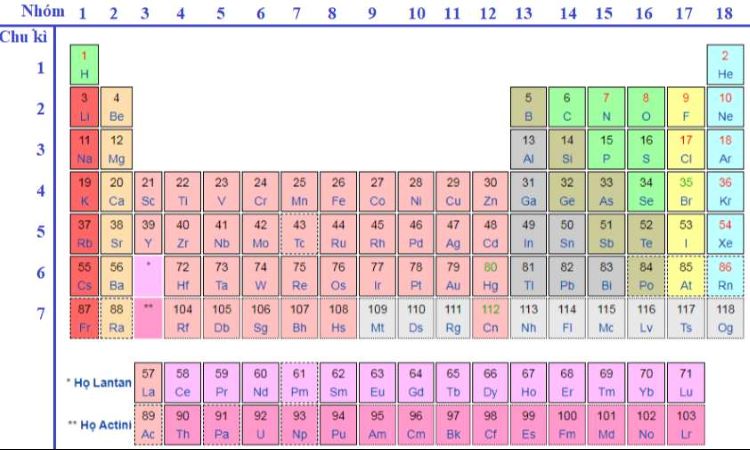
Bảng tuần hoàn nguyên tố hóa học Mendeleev
Cấu tạo của bảng tuần hóa hóa học
Ô nguyên tố: Sẽ thể hiện các thông tin về số hiệu nguyên tử, ký hiệu hóa học, tên nguyên tố cùng nguyên tử khối của nguyên tố hóa học trong ô.
Chu kỳ:
Đây là dãy các nguyên tố hóa học được sắp xếp theo chiều tăng dần về điện tích hạt nhân và các nguyên tử của chúng sẽ có cùng số lớp electron. Gồm tất cả 7 chu kỳ trong bảng tuần hoàn nguyên tố hóa học. Với chu kỳ 1, 2, 3 gọi là chu kỳ nhỏ còn chu kỳ 4, 5, 6, 7 gọi là chu kỳ lớn.
Nhóm nguyên tố:
Tập hợp các nguyên tố có tính chất tương tự như nhau do trong nguyên tử của chúng có cùng số electron lớp ngoài cùng. Bên cạnh đó chúng được xếp thành cột theo chiều tăng dần của điện tích hạt nhân theo thứ tự từ dưới lên trên.
Ngoài ra, khi học hóa, dưới đây là một số thuật ngữ các em cần nắm được
Số hiệu nguyên tử:
Hay còn gọi là số proton của nguyên tố hóa học. Tức là số proton của một nguyên tử và số điện tích của hạt nhân. Số hiệu nguyên tử sẽ có giá trị bằng số electron trong một nguyên tử trung hòa về điện. Đặc biệt, số hiệu nguyên tử cũng sẽ giúp xác định duy nhất một nguyên tố hóa học.
Tham khảo: Hướng dẫn vệ sinh máy lạnh
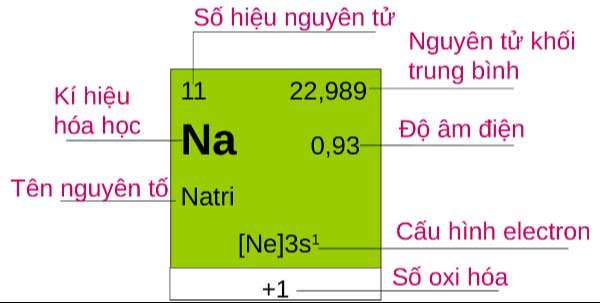
Cách đọc thông tin nguyên tố hóa học
Nguyên tử khối trung bình
Hầu hết, các nguyên tố hóa học thường là hỗn hợp của nhiều đồng vị khác nhau. Với tỉ lệ phần trăm số nguyên tử được xác định. Do đó, nguyên tử khối của các nguyên tố này được tính bằng nguyên tử khối trung bình của hỗn hợp đồng vị này dựa theo tỉ lệ phần trăm của các nguyên tử tương ứng.
Cấu hình electron
Cấu hình electron cho thấy sự phân bố của các hạt electron ở những trạng thái năng lượng khác nhau. Cụ thể trong lớp vỏ nguyên tử hoặc ở những nơi mà chúng hiện diện.
Độ âm điện:
Là khả năng hút electron trong quá trình tạo thành một liên kết hóa học. Cần lưu ý rằng độ âm điện tỉ lệ thuận với tính phi kim.Chẳng hạn, nếu độ âm điện của nguyên tố càng lớn, tính phi kim càng mạnh và chiều ngược lại.
Số oxi hóa:
Là số hóa trị sử dụng cho 1 hoặc 1 nhóm nguyên tử. Nhờ vào con số này, dễ dàng tính được số electron trao đổi khi tham gia phản ứng hóa học.
Tên nguyên tố:
Gồm 1 kiểu nguyên tử duy nhất, nó được phân biệt dựa trên số hiệu nguyên tử.
Ký hiệu hóa học:
Là tên viết tắt của nguyên tố hóa học, bao gồm 1 hoặc 2 chữ cái Latin. Chữ đầu tiên thường sẽ được viết hoa.
Ví dụ: Vị trí của oxi trong bảng tuần hoàn nguyên tố hóa học
Oxi có cấu hình là 1s22s22p4
Vậy vị trí của oxi trong bảng tuần hoàn nguyên tố hóa học là ở ô thứ 8; chu kỳ 2 (do oxi có 2 lớp electron); thuộc nhóm VIA (do 6 e hóa trị, nguyên tố p)
Tham khảo: Đề thi tiếng anh thpt quốc gia 2019 mã 401
1. Khi biết được vị trí của nguyên tố hóa học, ta có thể suy ra được tính chất, cấu tạo của các nguyên tố hóa học đó.
Chẳng hạn: Khi biết nguyên tố X có số hiệu nguyên tử là 16, và thuộc chu kỳ 3, nhóm VIA, ta có suy luận như sau:
Điện tích hạt nhân của nguyên tố X sẽ là 16+ và nguyên tố này có 16 electron (số hiệu nguyên tử là 16)
Nguyên tố X sẽ có 3 lớp electron (thuộc chu kỳ 3).
Lớp ngoài cùng của nguyên tố X sẽ có 6 electron (thuộc nhóm VIA).
2. Khi biết được cấu tạo nguyên tử của nguyên tố hóa học, ta dễ dàng suy ra được tính chất và vị trí của nguyên tố hóa học đó ở trong bảng tuần hoàn nguyên tố hóa học.
Ví dụ: Khi biết nguyên tố Z có điện tích hạt nhân là 12+ với 3 lớp electron và lớp ngoài cùng có 2 electron, ta có thể suy ra:
Nguyên tố Y nằm ở ô thứ 12 (có điện tích hạt nhân là 12+), thuộc chu kỳ 3 (có 3 lớp electron) và nhóm IIA (lớp ngoài cùng có 2 electron) trên bảng tuần hoàn.
Do nằm ở đầu chu kỳ, nên chắc chắn nguyên tố Y là kim loại.
Tham khảo: Nhà hàng có phòng riêng cầu giấy

Ý nghĩa của bảng tuần hoàn nguyên tố hóa học
Thực tế, học thuộc bảng tuần hóa hóa học không phải chuyện dễ dàng. Tuy nhiên không có nghĩa là không thể. Và cách học thuộc nhanh nhất, bạn có thể tham khảo 4 cách sau:
- Cách 1: Nghiên cứu bảng tuần hoàn
Kiến thức sẽ lưu giữ tốt nhất là khi chúng ta thực sự hiểu nó. Trong bảng tuần hoàn sẽ hiển thị các thông tin về tên, ký hiệu và số hiệu nguyên tử. Khi đó bạn chỉ cần nắm rõ 10 nguyên tố đầu tiên, như vậy tìm ra quy luật cho các nguyên tố còn lại.
- Cách 2: In và đặt bảng tuần hoàn hóa học tại những nơi dễ thấy, dễ nhìn
- Cách 3: Dùng phương pháp dễ nhớ
Để có thể nhớ lâu kiến thức trong bảng tuần hoàn, đầu tiên cần thường xuyên làm bài tập. Sau đó có thể áp dụng câu thơ/văn xuôi để dễ ghi nhớ:
“khi nào cần may áo giáp sắt nhớ sang phố hỏi cửa hàng Á Phi Âu” tương ứng với các nguyên tố: F, Na, Ca, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au. Hay “Lâu nay không rảnh coi phim” lần lượt là nguyên tố Li, Na, K, Rb, Cs, Pr.
- Cách 4: Học theo Bài ca hóa trị
Có một bài ca hóa trị được nhiều khóa học sinh truyền tai nhau:
“Kali, I – ốt, Hidro
Natri với Bạc, Clo một loài
Là hóa trị 1 bạn ơi
Nhớ ghi cho rõ kẻo rồi phân vân
Magie, Chì, Kẽm, Thủy ngân
Canxi, Đồng ấy cũng gần Bải
Cuối cùng thêm chú Oxi
Hóa trị 2 ấy có gì khó khăn
Bác Nhôm hóa trị 3 lần
Ghi sâu trí nhớ khi cần có ngay
Cacbon, Silic này đây
Là hóa trị 4 không ngày nào quên
Sắt kia kể cũng quen tên
2, 3 lên xuống thật phiền lắm thôi
Nito rắc rối nhất đời
1, 2, 3, 4 khi thời thứ 5
Lưu huỳnh lắm lúc chơi khăm
Xuống 2, lên 51 khi nằm thứ 4
Photpho nói tới không dư
Nếu ai hỏi đến thì hừ rằng 5
Em ơi cố gắng học chăm
Bài ca hóa trị suốt năm rất cần”.
Trên đây, chúng tôi đã tổng hợp những thông tin chi tiết về Bảng tuần hoàn hóa học. Hy vọng thông tin này hữu ích với quý độc giả. Đừng quên theo dõi những thông tin thú vị khác trên web Diamondschool.edu.vn nhé!